引用本文:中华医学会外科学分会胃肠学组, 中国医师协会外科医师分会肿瘤外科学组, 中国医师学会外科医师分会上消化道学组, 等. 中国胃癌保功能手术外科专家共识(2021版) [J] . 中华胃肠外科杂志, 2021, 24(5) : 377-382. DOI: 10.3760/cma.j.issn.441530-20210305-00102.
作者: 中华医学会外科学分会胃肠学组 中国医师协会外科医师分会肿瘤外科学组 中国医师学会外科医师分会上消化道学组 中国抗癌协会肿瘤胃肠病学分会
摘要
随着胃癌外科的发展,在保证手术治疗效果的前提下,尽可能保留残胃功能、减少对患者术后生活质量的影响,是患者的期望和医师的追求。功能保留胃切除术(FPG)理念的出现,标志着胃癌外科的发展进入了更加个体化、精准化的时代。由于FPG尚无明确统一的定义及手术标准与规范,由中华医学会外科学分会胃肠学组牵头,联合中国医师协会外科医师分会肿瘤外科学组、中国医师学会外科医师分会上消化道学组和中国抗癌协会肿瘤胃肠病学分会组织部分专家,综合国内外文献报道,就早期胃癌保留功能手术几经讨论后达成共识。FPG的定义为:早期胃癌在保证根治性切除的前提下,缩小手术范围,合理选择重建方式,尽可能保留胃的功能。其主要术式为缩小手术范围的术式(包括保留幽门的胃切除术、节段胃切除术、胃局部切除、内镜下切除)和近端胃切除(PG)。PG手术后的消化道重建除了远端残胃与食管吻合外,近年出现的有食管-管型胃吻合、双通道吻合(DTR)、间置空肠吻合、食管残胃侧侧吻合术(SOFY吻合)及双肌瓣吻合(Kamikawa吻合)等重建方式。对于胃保功能手术后的功能评价,主要为残胃功能(包括生理通道、胃储存和初步消化-分泌)的评价、功能相关性并发症及营养状况的评价。相信本共识的出台,必将推动临床功能保护性胃手术的规范开展,促进对胃癌疾病发展规律和胃癌手术后残胃功能认知的不断深入,进一步完善胃癌保功能手术的理论基础研究。同时也相信胃癌保功能手术的适应证和手术方式也必然会不断演进、扩大和更新。
胃癌发病率在全球恶性肿瘤中排名第5位,病死率排名第3位[1]。近年来,随着内镜技术的发展普及,早期胃癌的检出率逐年提高[2]。与进展期胃癌相比,早期胃癌具有转移率低和预后较好等特点,通过规范的手术治疗其5年生存率超过90%[3]。回顾日本推广标准D2根治手术的发展历史,真正从中获益的人群为Ⅱ、Ⅲ期的进展期胃癌患者,其术后5年生存率分别从20世纪60年代的47.7%和26.4%提高至2008年的73.1%和44.5%,但早期胃癌患者的总体生存率改善并不明显,仅从81.7%上升至90.3%[4]。D2标准根治手术对于早期胃癌存在过度治疗之嫌。因此,在保证预后的前提下探索功能保留胃切除术(function preserving gastrectomy,FPG),从而提高患者生活质量,成为当前胃癌的热点议题。而FPG尚无明确统一定义及手术标准与规范。由中华医学会外科学分会胃肠学组牵头,联合中国医师协会外科医师分会肿瘤外科学组、中国医师学会外科医师分会上消化道学组和中国抗癌协会肿瘤胃肠病学分会组织部分专家,综合国内外文献报道,就早期胃癌保留功能手术几经讨论后达成以下共识,为今后临床工作以及相关研究提供借鉴。
胃癌保功能外科手术的定义
FPG最早起源于胃溃疡的治疗。1952年,Wangensteen[5]首次将节段胃切除术(segmental gastrectomy,SG)用于胃溃疡的外科治疗;Ohwada等[6]于1999年通过改良SG术式用于治疗早期胃中部癌患者,结果显示,该术式具有良好的安全性和有效性,并显著改善了患者术后生活质量。1967年,Maki等[7]提出保留幽门的胃切除术(pylorus-preserving gastrectomy,PPG)用于治疗胃溃疡。随着对早期胃癌病理学特征以及手术安全性研究的不断深入,20世纪80年代末开始了PPG手术治疗早期胃癌的尝试,并逐步在安全性及有效性方面获得认可。2010年,在第3版《日本胃癌治疗指南》中,PPG已被列入早期胃癌的可选手术方式之一,适应证建议为cT1N0M0、肿瘤位于胃中段1/3、病灶下极距幽门>4 cm的胃癌患者[8]。
目前,比较公认的FPG三大要素为减少胃切除范围、保留幽门功能及保留迷走神经[9]。日本《胃癌处理规约》中,以根治性切除标准手术的要求切除2/3以上胃及行D2淋巴结清扫;而小于以上范围的根治性手术称为缩小手术。临床医生往往将胃功能保留手术等同于缩小手术,将标准远端胃及全胃根治术之外的缩小手术都归入FPG的范畴。因此,从广义上讲,与标准胃癌根治手术相比,减少了胃切除和(或)淋巴结清扫范围,术后残胃功能获得更多保留的局限性手术方式,都可视为FPG手术。
FPG手术通常包括PPG手术、近端胃切除(proximal gastrectomy,PG)、SG和胃局部切除(local gastrectomy,LG)等,SG是指小范围胃环周切除,LG指胃楔形切除并完整切除病灶。此外有学者认为,内镜下切除(endoscopic resection,ER)也是最佳的保留胃功能手术,包括内镜黏膜切除术(endoscopic submucosa resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),其主要应用于部分cT1N0肿瘤,但需严格把控指征[10]。而《日本胃癌治疗指南》中对于T1期肿瘤2 cm切缘距离的要求,为FPG手术开展提供了临床依据[11]。我国有学者提出,FPG在根治原发病灶、彻底清扫可疑淋巴结区域前提下,须保留胃的正常解剖结构,包括保留幽门、贲门及原有通道,同时保证残胃良好血供及神经支配,以保持正常消化及分泌功能,改善患者术后营养状况及生活质量[12]。
本共识中最终关于FPG定义为:早期胃癌在保证根治性切除的前提下,缩小手术范围,合理选择重建方式,尽可能保留胃的功能。
缩小手术范围的胃保功能术式
早期胃癌的缩小手术,无论是胃切除范围、还是淋巴结清扫程度,均明显小于标准胃癌根治手术。其主要挑战在于手术范围的缩小对肿瘤根治性的潜在影响,故精准诊断直接影响着本项技术的开展和推广。因此,建议术前通过超声内镜及多层螺旋CT等影像学手段,综合评估肿瘤位置、水平浸润范围、垂直浸润深度以及淋巴结和远处转移情况,对肿瘤做精准定位及分期,以选择最佳的切除方式。
( 一 ) 内 镜 下 切 除 ( E R )
内镜下切除是对胃癌早期病变在内镜下进行切除治疗,一般包括EMR和ESD。
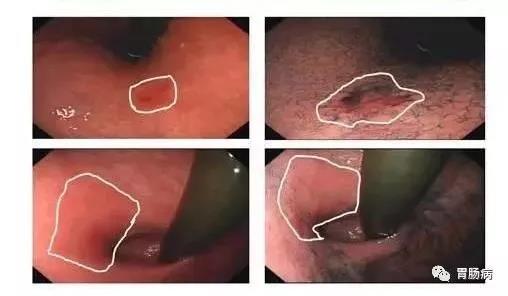
就胃功能保留而言,ESD是目前治疗cT1N0M0肿瘤的首选治疗方式,但需严格把握手术指征[13]。其绝对适应证包括:(1)无合并溃疡的分化型黏膜内癌;(2)病灶≤3 cm、有溃疡的分化型黏膜内癌;(3)胃黏膜高级别上皮内瘤变。此外;对于病灶≤2 cm、无溃疡的未分化型黏膜内癌,可作为内镜治疗的扩大适应证,酌情开展[14,15,16,17]。分化型胃癌切缘选择距离病变边缘3~5 mm,未分化型胃癌切缘需至少1 cm。
根据术后标本病理结果,ESD切除效果可评估为治愈性、相对治愈性及非治愈性切除。治愈性切除是指:病灶整块切除≤2 cm、垂直切缘与水平切缘阴性、无合并溃疡、且无脉管浸润的分化型黏膜内癌。相对治愈性切除是指:病灶整块切除、垂直切缘与水平切缘阴性、无脉管浸润且满足以下条件的早期胃癌:(1)直径>2 cm,无溃疡的分化型黏膜内癌;(2)直径≤3 cm,可伴溃疡的分化型黏膜内癌;(3)直径≤2 cm,无溃疡的未分化型黏膜内癌;(4)直径≤3 cm,分化型SM1。非治愈性切除是指除治愈性切除和相对治愈性切除以外的内镜下切除的早期胃癌,应追加外科手术,包括胃切除术及清扫相应淋巴结。
( 二 ) 胃 局 部 切 除 ( L G )
LG是指胃的非环周性切除,主要适用于未发生淋巴结转移的早期胃癌患者。一般通过腹腔镜与内镜联合进行胃壁全层的局部切除。
对于超出ESD治疗适应证及怀疑有胃周淋巴结转移可能的早期胃癌,可在具有丰富临床经验的胃癌治疗中心选择性开展腹腔镜-胃镜联合手术治疗(laparoscopic and endoscopic cooperative surgery for gastric tumors,LECS),即通过内镜辅助病灶定位和切除范围的标记,或在腹腔镜的观察和协助下通过内镜或腹腔镜进行胃壁的全层切除,再通过腹腔镜进行胃壁缺损的缝合或者器械关闭;对于有淋巴结转移风险的患者,可同时联合腹腔镜下行针对性的区域淋巴结清扫,以达到根治肿瘤的目的[18]。
前哨淋巴结(sentinel lymph node,SLN)被定义为原发肿瘤直接联系的第一站淋巴结,相较于单纯内镜下ESD技术,如果前哨淋巴结未发生转移,则无需进一步扩大淋巴结清扫范围。目前,用于前哨淋巴结导航技术(sentinel lymph node navigation skill,SNNS)的常用示踪剂有染料和放射性核素两类。染料包括亚甲蓝、纳米碳、吲哚菁绿等,放射性核素一般是锝标记的各种胶体作为示踪剂。有文献报道,通过染料法及放射性核素法双示踪剂标记,可取得更好的显影效能[19,20,21,22]。
SLN的确认及切除SLN的获取方法主要有两种:(1)拾取法,仅摘除被标记的淋巴结。这是目前应用于黑色素瘤及乳腺癌SLN状态的评估方法[23]。(2)切除前哨淋巴引流域(sentinel lymphatic basin,SLB),SLB定义为在染色时被已染色淋巴管道分离开的淋巴区域,胃癌SLB近端边界为附着于胃壁上的脂肪组织,远端边界为距胃最远端的已染色淋巴结的胃壁[24]。
由于胃癌的淋巴流向具有复杂性,且存在着多途径及跳跃性转移等问题,基于SNNS的FPG仍有待于多学科前瞻性研究的更深入探讨[25]。
( 三 ) 节 段 胃 切 除 ( S G )
SG是指同时保留胃幽门及贲门的小范围胃环周切除,最具代表性的是PPG手术。Maki等[7]于1967最早提出PPG并应用于胃溃疡治疗。20世纪70年代,随着早期胃癌定义的提出及其组织病理学发展,PPG手术在治疗早期胃癌的安全性及有效性得到认可,成为经典的保留功能胃切除术式。目前公认的早期胃癌行PPG手术的适应证为:术前评估cT1N0、且肿瘤位于胃中段1/3的早期胃癌患者,病灶下极距幽门>4 cm(肿瘤下缘距离下切缘2 cm,下切缘距离幽门管至少2 cm)[8,26]。除此之外,有学者指出,对于侵犯胃上1/3的早期胃癌(无论是术前内镜检查和术后病理证实),满足肿瘤近端边界距离食管胃结合部(esophagogastric junction,EGJ)≥3 cm,肿瘤远端边界距幽门>4 cm,也同样可以行PPG手术[27]。由于目前PPG手术大多选择腹腔镜下清扫后再辅助小切口切除吻合,因此推荐术前胃镜定位肿瘤的近端及远端切缘。如开展全腹腔镜PPG手术,建议术中胃镜辅助定位,以保证安全切缘。
PPG手术的D1淋巴结清扫范围包括No.1、No.3、No.4sb、No.4d、No.6和No.7淋巴结,D1+淋巴结清扫则增加了No.8a和No.9淋巴结。由于PPG手术需要完整保留胃窦的神经及血供,相应区域淋巴结清扫(No.1、No.5、No.6和No.12)会受到影响,尤其由于迷走神经肝支及幽门支与肝固有动脉及胃右动脉伴行,无法对No.5及No.12淋巴结实施清扫,以上原因会导致术者对根治手术的彻底性产生担忧。但之前的回顾性研究发现,对于肿瘤位于胃中1/3的T1期胃癌,No.5淋巴结的转移发生率仅0~0.5%,而作为胃癌转移的第2站淋巴结,No.12淋巴结转移的发生率更低[28,29]。该术式的技术要点为胃切除范围应保留足够的幽门袖长度(应尽量>3 cm);保留幽门下静脉及迷走神经肝支、腹腔支和幽门支;清扫范围限于No.6a和No.6v淋巴结;胃中部早期癌无No.6i淋巴结转移,可不予清扫[30,31]。
根据第5版《日本胃癌治疗指南》推荐,PG和全胃切除均可作为上1/3早期胃癌的可选择术式。由于全胃切除术后常伴随体质量下降和营养吸收障碍,甚至出现严重低蛋白血症或贫血[32]。因此,对于发生于胃上1/3的早期胃癌,更多学者仍推荐采用PG[33,34,35]。
( 一 ) P G 手 术 适 应 证
(1)早期胃癌位于胃上1/3或EGJ;(2)保证下切缘2 cm,远端残胃≥1/2[36];(3)术前检查(CT及超声内镜)未发现淋巴结转移[37];(4)肿瘤最大直径≤4 cm[39];(5)内镜下治疗(EMR或ESD)后的补救手术。
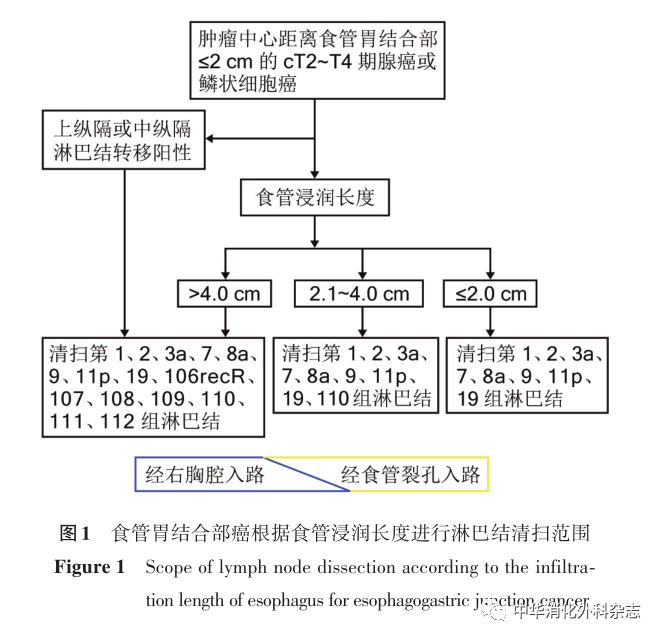
对于PG手术,需满足切除后残胃有足够的容积,即残胃容量至少达到切除前容量的1/2。PG手术的淋巴结清扫范围包括:D1(No.1、No.2、No.3a、No.4sa、No.4sb和No.7淋巴结)或D1+(D1淋巴结+No.8a、No.9和No.11p)淋巴结清扫。行淋巴结清扫时注意保护迷走神经肝支,后者由迷走神经前干在膈肌裂孔平面发出,沿食管右侧下行,有数个小分支在肝胃韧带紧靠肝下缘走向肝十二指肠韧带,腹腔镜下清晰可辨。不推荐PG手术时常规行幽门成型术。
( 二 ) P G 手 术 后 的 消 化 道 重 建
经典PG术后的消化道重建方式是远端残胃与食管吻合,因具有操作简单、吻合口少、保留正常生理途径、保留一定的残胃储存功能等特点,临床上一直在沿用。但贲门功能的缺失导致较高的胃食管反流发生率和严重的症状,使得患者的生活质量较低。为了解决PG残胃食管吻合引起的食管反流,多年来进行了大量的探索,出现了食管-管型胃吻合、双通道吻合(double tract reconstruction,DTR)、间置空肠吻合、食管残胃侧侧吻合术(SOFY,又称Side Overlap吻合)、双肌瓣吻合(double flap,又称Kamikawa吻合术)等重建方式[36,39]。
四 胃保功能手术后的功能评价
胃的生理功能主要包括:(1)生理通道功能;(2)储存、运输及排空功能:食物进入胃内,胃壁随之扩展,适应容纳食物的需要;(3)分泌及初步消化功能:在胃黏膜分泌胃酸和胃蛋白酶原的共同作用下,能使食物中的蛋白质初步分解。因此,胃保功能手术后,需要评估食物接收、食物存储、分泌胃液以及食物消化、运输和排空等功能情况。目前尚无胃保功能术后的功能评价标准,临床多通过生活质量量表进行评价,具有较高的主观性;而通过内镜、血液学检查等客观手段进行评估,虽然能够提示功能重建给患者带来的生活质量获益程度,但是循证医学证据等级有限[40]。现提出一种包含功能保留性胃切除术的残胃功能、术后并发症、术后营养状况和辅助检查等项目并赋予不同权重的胃功能评价标准。各项目之间的权重以及各要素的取舍,需不断更新的循证医学证据支持。
( 一 ) 胃 切 除 术 后 的 残 胃 功 能 评 价
1.生理通道功能评价:
保留贲门的胃切除术、管状胃成形术、间置空肠和DTR等较传统术式,有效降低了术后反流性食管炎的发生率。双肌瓣吻合、SOFY吻合等在一定程度上重建了贲门功能,降低了食管反流发生率[41,42,43]。保留幽门远端胃切除术有效降低胃排空延迟、倾倒综合征及胆汁反流性疾病等并发症[44]。上述功能可通过胃镜、水溶性造影、pH监测、食管测压等检查进行评价。
2.胃储存功能评价:
评价胃储存功能主要是了解胃残余容量和排空节律。PG、STG、PPG、部分胃切除术、内镜手术、各类空肠储袋及间置空肠等都可以达到保留胃容量的目的[45]。PPG手术可保留部分幽门的节律性排空功能,并可维持胆囊收缩功能[44]。胃残余容量和排空节律可通过核素造影检查予以明确并进行评价。
3.初步消化-分泌功能评价:
主要分为物理性和化学性两类,前者通过胃壁的蠕动对食物进行初步的研磨和混合,后者则主要通过胃酸和胃蛋白酶的分泌得以实现。消化功能可通过缩小胃切除范围进行保留,主要通过胃酸检测予以评价。
( 二 ) 胃 切 除 术 后 功 能 相 关 性 并 发 症 评 价
胃切除术后功能相关性并发症主要包括:贲门相关并发症(如反流性食管炎)、幽门相关并发症(倾倒综合征、胃潴留、胃排空障碍)、胆相关并发症(胆囊失功能、胆汁反流)和其他胃功能相关并发症(残胃炎、吻合口狭窄)。术后功能相关性并发症评价尚缺乏统一的评价体系。
( 三 ) 胃 切 除 术 后 营 养 状 况 评 价 及 辅 助 检 查
患者术后营养状况对功能保留性胃切除术评价具有重要价值。患者主观整体评估(patient-generated subjective global assessment,PG-SGA)营养评估量表是肿瘤患者一种特异性营养状况评估工具,生化指标及营养风险筛查(NRS2002)也是重要参考依据。另外,肠管内钡剂储留时间、代胃肠管最大直径等辅助检查也可相应得分,但有待循证医学进一步的证据支持。
五 前景展望
外科手术在治疗疾病的同时,也会带给患者创伤和功能损失。随着胃癌外科的发展,在保证手术治疗效果的前提下,尽可能保留残胃功能、减少对患者术后生活质量的影响,是患者的期望和医师的追求。胃癌保功能手术理念的出现,标志着胃癌外科的发展进入了更加个体化、精准化的时代。但由于我国早期胃癌比例较低,故拟开展此方面工作的中心须重视相关培训,在确保患者利益的前程下积极谨慎开展。相信随着我们对胃癌疾病发展规律和胃癌手术后残胃功能认知的不断深入,胃癌保功能手术的理论基础不断完善,胃癌保功能手术的适应证和手术方式也必然会不断演进、扩大和更新。
《胃癌保功能外科手术中国专家共识》专家组
审核:秦新裕(上海复旦大学附属中山医院)、季加孚(北京大学肿瘤医院)、陈凛(解放军总医院)、李国新(南方医科大学附属南方医院)
成员(按姓氏拼音首字母排序):陈凛(解放军总医院)、樊林(西安交通大学附属第一医院)、胡文庆(山西医科大学附属长治市人民医院)、季加孚(北京大学肿瘤医院)、季刚(空军军医大学西京医院)、靖昌庆(山东第二医科大学附属山东省立医院)、李国新(南方医科大学附属南方医院)、李子禹(北京大学肿瘤医院)、梁品(大连医科大学附属第一医院)、刘凤林(上海复旦大学附属中山医院)、钱锋(陆军军医大学西南医院)、秦新裕(上海复旦大学附属中山医院)、宋武(中山大学附属第一医院)、王权(吉林大学第一医院)、卫勃(解放军总医院)、余江(南方医科大学附属南方医院)、臧潞(上海交通大学医学院附属瑞金医院)、赵刚(上海交通大学医学院附属仁济医院)、赵高平(四川省人民医院)、郑朝辉(福建医科大学附属协和医院)、朱甲明(中国医科大学附属第一医院)执笔:赵刚、胡文庆、季刚、梁品
滑动阅读参考文献
[1]BrayF, FerlayJ, SoerjomataramI, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[2]王胤奎,李子禹,陕飞,等.我国早期胃癌的诊治现状——来自中国胃肠肿瘤外科联盟数据的启示[J].中华胃肠外科杂志,2018,21(2):168-174. DOI:10.3760/cma.j.issn.1671-0274.2018.02.010.
[3]KimHH, HanSU, KimMC, et al. Effect of laparoscopic distal gastrectomy vs open distal gastrectomy on long-term survival among patients with stage I gastric cancer: the KLASS-01 randomized clinical trial[J]. JAMA Oncol, 2019, 5(4): 506-513. DOI: 10.1001/jamaoncol.2018.6727
[4]MaruyamaK, KataiH. Surgical treatment of gastric cancer in Japan, trend from standardization to individualization[J]. Chirurgia(Bucur), 2014, 109(6): 722-730.
[5]WangensteenOH. Segmental gastric resection for peptic ulcer;method permitting restoration of anatomic continuity[J]. 1952, 149(1): 18-23. DOI: 10.1001/jama.1952.02930180020005.
[6]OhwadaS, NakamuRAS, OgawaT, et al. Segmental gastrectomy for early cancer in the mid-stomach[J]. Hepatogastroenterology, 1999, 46(26): 1229-1233.
[7]MakiT, ShiratoriT, HatafukuT, et al. Pylorus-preserving gastrectomy as an improved operation for gastric ulcer[J]. Surgery, 1967, 61(6): 838-845.
[8]Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010(ver. 3)[J]. Gastric Cancer, 2011, 14(2): 113-123. DOI: 10.1007/s10120-011-0042-4.
[9]ShinoharaT, OhyamaS, MutoT, et al. Clinical outcome of high segmental gastrectomy for early gastric cancer in the upper third of the stomach[J]. Br J Surg, 2006, 93(8): 975-980. DOI: 10.1002/bjs.5388.
[10]HasuikeN, OnoH, BokuN, et al. A non-randomized confirmatory trial of an expanded indication for endoscopic submucosal dissection for intestinal-type gastric cancer(cT1a): the Japan Clinical Oncology Group study(JCOG0607)[J]. Gastric Cancer, 2018, 21(1): 114-123. DOI: 10.1007/s10120-017-0704-y.
[11]Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018(5th edition)[J]. Gastric Cancer, 2021, 24(1): 1-21. DOI: 10.1007/s10120-020-01042-y.
[12]赵刚,徐佳,王书昌.保留功能胃切除术的争议与共识[J].中国实用外科杂志,2018. DOI:10.19538/j.cjps.issn1005-2208.2018.02.09
[13]NomuraE, OkajimaK. Function-preserving gastrectomy for gastric cancer in Japan[J]. World J Gastroenterol2016, 22(26): 5888-5895. DOI: 10.3748/wjg.v22.i26.5888.
[14]北京市科委重大项目早期胃癌治疗规范研究专家组.早期胃癌内镜下规范化切除的专家共识意见(2018,北京)[J].中华消化内镜杂志,2019,36(6):381-392. DOI:10.3760/cma.j.issn.1007-5232.2019.06.001
[15]OnoH, YaoK, FujishiroM, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer[J]. Dig Endosc, 2016, 28(1): 3-15. DOI: 10.1111/den.12518.
[16]AjaniJA, D'AmicoTA, AlmhannaK, et al. Gastric cancer, version 3.2016, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2016, 14(10): 1286-1312. DOI: 10.6004/jnccn.2016.0137.
[17]Pimentel-NunesP, Dinis-RibeiroM, PonchonT, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy(ESGE)Guideline[J]. Endoscopy, 2015, 47(9): 829-854. DOI: 10.1055/s-0034-1392882.
[18]NunobeS, HikiN, GotodaT, et al. Successful application of laparoscopic and endoscopic cooperative surgery(LECS)for a lateral-spreading mucosal gastric cancer[J]. Gastric Cancer, 2012, 15(3): 338-342. DOI: 10.1007/s10120-012-0146-5.
[19]EomBW, YoonHM, MinJS, et al. Prospective multicenter feasibility study of laparoscopic sentinel basin dissection after endoscopic submucosal dissection for early gastric cancer: SENORITA 2 trial protocol[J]. J Gastric Cancer, 2019, 19(2): 157-164. DOI: 10.5230/jgc.2019.19.e12.
[20]HuangL, WeiT, ChenJ, et al. Feasibility and diagnostic performance of dual-tracer-guided sentinel lymph node biopsy in cT1-2N0M0 gastric cancer: a systematic review and meta-analysis of diagnostic studies[J]. World J Surg Oncol, 2017, 15(1): 103. DOI: 10.1186/s12957-017-1159-7.
[21]KitagawaY, TakeuchiH, TakagiY, et al. Sentinel node mapping for gastric cancer: a prospective multicenter trial in Japan[J]. J Clin Oncol, 2013, 31(29): 3704-3710. DOI: 10.1200/JCO.2013.50.3789.
[22]WangZ, DongZY, ChenJQ, et al. Diagnostic value of sentinel lymph node biopsy in gastric cancer: a meta-analysis[J]. Ann Surg Oncol, 2012, 19(5): 1541-1550. DOI: 10.1245/s10434-011-2124-2.
[23]SymeonidisD, TepetesK. Techniques and current role of sentinel lymph node(SLN)concept in gastric cancer surgery[J]. Front Surg, 2018, 22(5): 77. DOI: 10.3389/fsurg.2018.00077.
[24]PiazzaG, CreagerMA. Thromboangiitis obliterans[J]. Circulation, 2010, 121(16): 1858-1861. DOI: 10.1161/CIRCULATIONAHA.110.942383.
[25]TakeuchiH, GotoO, YahagiN, et al. Function-preserving gastrectomy based on the sentinel node concept in early gastric cancer[J]. Gastric Cancer, 2017, 20(Suppl 1): 53-59. DOI: 10.1007/s10120-016-0649-6.
[26]中华医学会外科学分会胃肠外科学组.保留幽门胃切除手术专家共识及操作指南(2019版)[J].中国实用外科杂志,2019,39(5):412-418. DOI:10.19538/j.cjps.issn1005-2208.2019.05.02.
[27]ZhuCC, CaoH, BerlthF, et al. Pylorus-preserving gastrectomy for early cancer involving the upper third: can we go higher?[J]. Gastric Cancer, 2019, 22(4): 881-891. DOI: 10.1007/s10120-018-00921-9.
[28]KimBH, HongSW, KimJW, et al. Oncologic safety of pylorus-preserving gastrectomy in the aspect of micrometastasis in lymph nodes at stations 5 and 6[J]. Ann Surg Oncol, 2014, 21(2): 533-538. DOI: 10.1245/s10434-013-3252-7.
[29]KongSH, KimJW, LeeHJ, et al. The safety of the dissection of lymph node stations 5 and 6 in pylorus-preserving gastrectomy[J]. Ann Surg Oncol, 2009, 16(12): 3252-3258. DOI: 10.1245/s10434-009-0646-7.
[30]MizunoA, ShinoharaH, HarutaS, et al. Lymphadenectomy along the infrapyloric artery may be dispensable when performing pylorus-preserving gastrectomy for early middle-third gastric cancer[J]. Gastric Cancer, 2017, 20(3): 543-547. DOI: 10.1007/s10120-016-0632-2.
[31]HarutaS, ShinoharaH, UenoM, et al. Anatomical considerations of the infrapyloric artery and its associated lymph nodes during laparoscopic gastric cancer surgery[J]. Gastric Cancer, 2015, 18(4): 876-880. DOI: 10.1007/s10120-014-0424-5.
[32]WenL, ChenXZ, WuB, et al. Total vs. proximal gastrectomy for proximal gastric cancer: a systematic review and meta-analysis[J]. Hepatogastroenterology, 2012, 59(114): 633-640. DOI: 10.5754/hge11834.
[33]MasuzawaT, TakiguchiS, HiraoM, et al. Comparison of perioperative and long-term outcomes of total and proximal gastrectomy for early gastric cancer: a multi-institutional RETrospective study[J]. World J Surg, 2014, 38(5): 1100-1106. DOI: 10.1007/s00268-013-2370-5.
[34]TakiguchiN, TakahashiM, IkedaM, et al. Long-term quality-of-life comparison of total gastrectomy and proximal gastrectomy by postgastrectomy syndrome assessment scale(PGSAS-45): a nationwide multi-institutional study[J]. Gastric Cancer, 2015, 18(2): 407-416. DOI: 10.1007/s10120-014-0377-8.
[35]SonMW, KimYJ, JeongGA, et al. Long-term outcomes of proximal gastrectomy versus total gastrectomy for upper-third gastric cancer[J]. J Gastric Cancer, 2014, 14(4): 246-251. DOI: 10.5230/jgc.2014.14.4.246.
[36]《近端胃切除消化道重建中国专家共识》编写委员会.近端胃切除消化道重建中国专家共识(2020版)[J].中华胃肠外科杂志, 2020, 23(2): 101-108. DOI: 10.3760/cma.j.issn.1671-0274.2020.02.002.
[37]HölscherAH, LawS. CORRection to: Esophagogastric junction adenocarcinomas: individualization of resection with special considerations for Siewert type II, and Nishi types EG, E=G and GE cancers[J]. Gastric Cancer, 2020, 23(1): 10. DOI: 10.1007/s10120-019-01032-9.
[38]YamashitaH, SetoY, SanoT, et al. Results of a nation-wide RETrospective study of lymphadenectomy for esophagogastric junction carcinoma[J]. Gastric Cancer, 2017, 20(Suppl 1): 69-83. DOI: 10.1007/s10120-016-0663-8.
[39]KamikawaY, KobayashiT, KamiyamaS, et al. A new procedure of esophagogastrostomy to prevent reflux following proximal gastrectomy(in Japanese)[J]. Shoukakigeka, 2001, 24: 1053-1060.
[40]ChinAC, EspatNJ. Total gastrectomy: options for the restoration of gastrointestinal continuity[J]. Lancet Oncol, 2003, 4(5): 271-276. DOI: 10.1016/s1470-2045(03)01073-8.
[41]HosodaK, WashioM, MienoH, et al. Comparison of double-flap and OrVil techniques of laparoscopy-assisted proximal gastrectomy in preventing gastroesophageal reflux: a retrospective cohort study[J]. Langenbecks Arch Surg, 2019, 404(1): 81-91. DOI: 10.1007/s00423-018-1743-5.
[42]MuraokaA, KobayashiM, KokudoY. Laparoscopy-assisted proximal gastrectomy with the hinged double flap method[J]. World J Surg, 2016, 40(10): 2419-2424. DOI: 10.1007/s00268-016-3510-5.
[43]YamashitaY, YamamotoA, TamamoriY, et al. Side overlap esophagogastrostomy to prevent reflux after proximal gastrectomy[J]. Gastric Cancer, 2017, 20(4): 728-735. DOI: 10.1007/s10120-016-0674-5.
[44]胡祥,张驰,曹亮,等.腹腔镜下保留幽门及迷走神经的胃切除术治疗早期胃中部癌疗效分析[J].中华胃肠外科杂志,2016,19(8):892-897. DOI:10.3760/cma.j.issn.1671-0274.2016.08.019.
[45]LiZ, DongJ, HuangQ, et al. Comparison of three digestive tract reconstruction methods for the treatment of Siewert II and III adenocarcinoma of esophagogastric junction: a prospective, randomized controlled study[J]. World J Surg Oncol, 2019, 17(1): 209. DOI: 10.1186/s12957-019-1762-x.